
İyonlaşma Nedir? İyonlaşma Enerjisi Ne Anlama Gelmekte?
Bu yazının içinde neler var?
Fizik biliminin en önemli kavramları arasında yer alan iyonlaşma enerjisi, maddeyi ve hareketlerini incelemek için kullanılan önemli kavramlar arasında yer alır. Bir atomun elektron alarak veya vererek kararlı hale geçmesini tanımlayan iyonlaşmanın gerçekleşmesi için enerjiye ihtiyaç vardır.
Kimya ve fizik alanlarını yakından ilgilendiren bu kavram, maddeyi tanımlayabilmeyi mümkün kılar. Atomların kararlı hale gelebilmeleri için gerekli olan iyonlaşma enerjisi, bilim dünyasında üzerinde durulan bir konudur.
Kimyasal tepkime alanlarında önemli bir yere sahip olan iyonlaşma enerjisine dair tüm detayları öğrenmek ve konu hakkında kapsamlı bilgiye sahip olmak için yazının devamına birlikte bakalım.
İyonlaşma Enerjisi Nedir?
Atomik yapı, periyodik çizelgedeki değişimler ve kimyasal reaksiyonlar ile alakalı konuları tam olarak anlayabilmek için temel rol oynayan iyonlaşma enerjisi, bazı kişiler için anlaşılması zor kavramlar içinde yer alır.
İyonizasyon enerjisi olarak da isimlendirilen iyonlaşma enerjisi, herhangi bir atomun temel haldeki elektronunu atomdan koparmak için ihtiyaç duyduğu enerji miktarı şeklinde açıklanır. Atomların kararlı hale geçme sürecinin genel bir ismi olarak öne çıkan iyonizasyon, kimya biliminin temel olaylarından bir tanesidir.
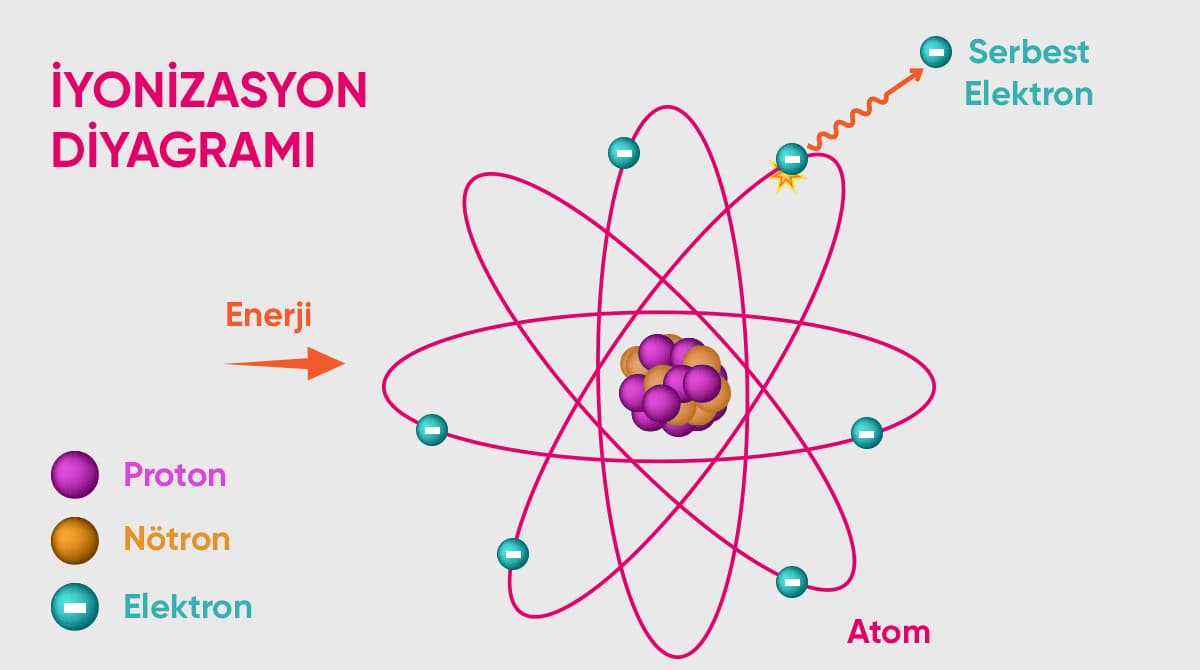
İyonlaşma enerjisini tam olarak kavrayabilmek için öncelikli olarak iyonlaşma kavramının öğrenilmesi gerekir. İyonlaşma, bir atomun kararlı hale geçmesini sembolize eder. Bir atom için kararlı hale geçmek ise elektron alarak veya vererek gerçekleşir. Kararlı hale geçme sonucu oluşan moleküllere ise iyon ismi verilir.
İyonların kararsız yapıları, fazla gelen enerjilerinden kurtulmak için diğer atomlarla etkileşime girmesi mecbur hale getirir. Bu etkileşim elektron alışverişi şeklinde gerçekleşir. Atomların bu etkileşim sürecine iyonizasyon veya iyonlaşma ismi verilir ve bu reaksiyonun gerçekleşmesi için gereksinim duyulan minimum düzeydeki enerjiye de iyonlaşma enerjisi denir.
Daha detaylı incelenecek olursa elektron vererek pozitif yüke ulaşan atomlara katyon, elektron alarak negatif yüke kavuşan atomlara anyon ismi verilir. Bu şekilde oluşan bileşiklere ise iyonik bağlı bileşikler denir.
Atomların neden iyonlaştığını öğrenmek, iyonlaşma enerjisini daha iyi kavrayabilmek adına önemlidir. Atomlar, enerjilerini minimize etme eğilimindedir. Bunu yapmanın en başarılı yolu ise elektronlarının yer aldığı orbitallerini (elektronların atom çekirdeği etrafındaki konumunu tanımlayan hacimsel alan), kapasiteleri doğrultusunda maksimum düzeyde elektronla doldurmaktır.
Bu noktada verilebilecek en iyi örnek soygazlardır. Halihazırda kararlı yapıda oldukları için iyonlaşmaya ihtiyaç duymayan soygazların tepkimeye girerek bileşik oluşturma ihtimalleri oldukça düşüktür. Periyodik tabloda yer alan 188 elementten yalnızca 7 tanesi soygaz olduğundan diğer 11 element kararlı hale geçmek için iyonlaşma gerçekleştirir.
Mol cinsinden ifade edilen ve İ harfi ile gösterilen iyonlaşma enerjisi, gaz haldeki nötr bir atomun elektron kazanma sürecindeki enerji değişiminin ölçüsüdür. Kimya biliminin en önemli olayları içerisinde yer alan iyonlaşma enerjisi, her atom için endotermiktir. Endotermik olay, temelde bir sistemin çevresinden ısı formunda enerji absorbe etmesi anlamına gelir. Bu enerji alımı ile atom, elektron kaybı yaşayarak pozitif yüklü bir iyon haline gelir.
İyonlaşma enerjisinin bir diğer tanımı ise, bir atomda yer alan elektronların çekirdek tarafından ne kadar kuvvetle çekildiğini belirten ölçüsüdür. İyonlaşma enerjisi aynı zamanda elektronlar ve çekirdek arasındaki bağın koparılması için gereklidir. Periyodik tabloda soldan sağa doğru gidildikçe iyonlaşma enerjisinde artışlar gözlenir. Bu artma düzenli değildir.
Birinci ve İkinci İyonlaşma Enerjisi Nedir?
İyonlaşma enerjisi birinci ve ikinci olmak üzere iki aşamada incelenir. Atomların gaz halinde izole bir iyon oluşturmak için ihtiyaç duyduğu minimum enerjiye birinci iyonlaşma enerjisi denir.
İlk elektron koparma işleminden sonra, ihtiyaç duyulan ikinci elektronun koparılması için gerekli olan enerjiye ikinci iyonlaşma enerjisi adı verilir. Bu işlem sonra +1 iyonu, +2 iyonu haline gelir. İkinci iyonlaşma olayı için elementin en dış katmanında yer alan ve diğer elementlere görece daha az kuvvetle bağlanan elektrona ihtiyaç vardır.
Birinci iyonlaşma enerjisi, periyodik tabloda genellikle soldan sağa doğru ilerledikçe artar. Bu artışın temeldeki nedeni, en dışta yer alan elektronun çekirdeğe daha güçlü bir bağla bağlanmasını sağlayan çekirdek yüküdür.

İkinci iyonlaşma enerjisi ile periyot numarası arasında ters orantı bulunur. Her atomun, sahip olduğu elektron sayısı kadar iyonlaşma enerjisi bulunur. Örneğin; hidrojen atomlarında tek element bulunduğu için yalnızca birinci iyonlaşma enerjisi için uygun kimyasal yapıya sahiptir. Helyum atomu iki elektronlu olduğu için birinci ve ikinci iyonlaşma enerjisini gerçekleştirebilir.
Kısaca bir atomun iyonlaşma enerjisi elektron sayısına göre artar ve bu durum da şu şekilde ifade edilir:
İE1 < İE2 < İE3 < İE4 < ……
Bu sıralamanın temel sebebi; elektron koparıldığında çekirdekte bulunan çekim gücünün düşmemesi ve elektromanyetik kuvvetin artmasıdır. Elektromanyetik kuvvet ise elektron sayısı azaldığından artar.
İyonlaşma için ihtiyaç duyulan enerji miktarı her zaman bir öncekinden daha fazladır. Bu sebeple elektron koparıldıktan sonra, diğer elektronları koparmak için daha yüksek bir enerjiye ihtiyaç duyulur. Nötr yüklü bir atomun + veya - hale gelmesi için ihtiyaç duyulan reaksiyonu gerçekleştiren birinci ve ikinci iyonlaşma enerjisi, kısaca bu şekilde tanımlanır.
İyonlaşma Enerjisinin Özellikleri Nelerdir?
Fizik ve kimya bilimi için en önemli kavramlardan biri olan enerji, çeşitli faaliyetlerin gerçekleştirilebilmesi için ihtiyaç duyulan güçtür.
İş yapabilme yeteneğini ifade eden enerji kavramı, iyonlaşma işlemi için de olmazsa olmaz bir görev üstlenir. Daha az kuvvetle daha fazla performansı mümkün hale getiren iyonlaşma enerjisi, gaz haldeki atomdan 1 mol enerji koparabilmeyi mümkün hale getirir. Asitlerin ve bazların iyonlaşması, + ve - yüklerine ayrılması anlamına gelir.
İyonlaşma enerjisinin genel özellikleri şu şekilde sıralanır:
- Periyodik tabloda aşağı doğru gidildikçe enerji düzeyi artar.
- Koparılan her 1 mol elektronda minimum enerji iyonlaşması sağlanır.
- Periyodik tabloda gruplara göre 1a < 3a < 2a <4a < 6a < 5a < 7a < 8a şeklinde artar.
- Her atom için endotermiktir.
- Gerçekleşen iyonlaşma reaksiyonu için gerekli olan enerji miktarı her zaman bir öncekinden daha fazladır. Bu durum İE1 < İE2 şeklinde ifade edilir.
- Aynı atom için geçerli olmak üzere birinci, ikinci, üçüncü ve dördüncü elektronları koparmak için sarf edilen enerjiye; birinci iyonlaşma enerjisi, ikinci iyonlaşma enerjisi, üçüncü iyonlaşma enerjisi ve dördüncü iyonlaşma enerjisi adı verilir.
- iyonlaşma enerjisi daima en küçüktür.
- İyonlaşma enerjisinin tepkimesini ifade ederken; Y(gaz) E+1 ---> Y+ e+ sembolü kullanılır.
- İyonlaşma enerjisi ve çekirdek arasında ters orantı bulunur.
- İyonlaşma esnasında atomun proton sayısı değişmez, sabittir.
- Periyodik tablo hakkında kapsamlı bilgiye ulaşmayı mümkün kılar.
- Aynı periyotta sağa doğru gidildikçe iyonlaşma enerjisi genellikle artar.
- Periyodik cetvelde sağa doğru gidildikçe atom çapı küçülür. Çap küçüldükçe çekirdeğe olan bağlılık artacağından elektronu koparmak için daha büyük bir enerjiye ihtiyaç duyulur.
- Farklı atomların iyonlaşma enerjileri arasında kıyaslama yapılırken ilk bakılması gereken nokta grup numaralarıdır.
- Grup numaraları aynı olan atomlarda periyot numaraları incelenmelidir.
İyonlaşma Enerjisi Nasıl Artar?
Hem kimya hem fizik biliminde sıklıkla karşılaşılan kavramlardan biri olan iyonlaşma enerjisi, her iki bilimde de farklı birimlerle ifade edilir.
Fizikte iyonlaşma enerjisi EV (Elektron Volt) olarak ifade edilirken kimyada; KJ/mol (Molar Birimler) şeklinde belirtilir.
Periyodik tabloda soldan sağa doğru gidildikçe iyonlaşma enerjisi artarken bir grup içerisinde atomun boyutu büyüdükçe iyonlaşma enerjisi azalır. Soldan sağa doğru gidildikçe iyonlaşma enerjisinin artmasının sebebi, elektrik çekim gücüdür. Atomların çapları küçülür ve böylece çekirdeğe daha yüksek bir çekimle bağlanır. Bu bağı koparmak için de daha yüksek bir enerjiye ihtiyaç vardır.
Değerlik elektron sayısı, temel enerji düzeyi, elektron alışverişi ve elektron ilgisi, iyonlaşma enerjisini artıran faktörler arasında yer alır.
Periyodik tablo içerisinde de bazı istisnalar bulunur. Örneğin borun ilk iyonlaşma enerjisi berilyumun iyonlaşma enerjisinden daha azdır. Aynı şekilde oksijenin ilk iyonlaşma enerjisi değeri de azotun iyonlaşma enerjisi değerinden daha azdır. Bu örnekler istisna olarak kabul edilir ve genellemeyi bozmaz.
İyonlaşma enerjisinin nasıl arttığı, kimyasal reaksiyonlar alanında araştırma yapan kişiler tarafından merak konusudur. İyonlaşma enerjisi grup boyunca aşağıdan yukarıya doğru da artış gösterir. İyonlaşma enerjisinde meydana gelen değişimler bir elementin bulunduğu grup numarası hakkında bilgi verir.
Atomlar Neden İyonlaşır?
Atomlar, elektron alarak veya vererek kararlı hale gelmek için iyonlaşır.
Atom altı parçacıklar, atomlar, moleküller ve iyonlarla çarpışma ve manyetik radyasyon sonucu iyonlaşma görülebilir. İyon çiftlerinin oluşumu üzerinde etkili olan diğer unsurlar arasında ise; heterolitik bağ bölünmesi ve heterolitik ikame reaksiyonları bulunur. Bu reaksiyonların başarılı bir şekilde tamamlanması, iyonlaşmayı da beraberinde getirir.
Atomlar, enerjilerini minimuma indirme eğilimindedirler. Bunu başarmanın en iyi yolu ise orbitallerini maksimum elektronla doldurmaktır. Soygazlar hazırda kararlı yapıda bulundukları için iyonlaşmaya ihtiyaç duymazlar. Periyodik tabloda yer alan diğer atomlar kararlı hale gelebilmek için iyonlaşma gerçekleştirir. Atomların iyonlaşma süreçlerini başarılı bir şekilde başlatabilmeleri için Oktet Kuralına uymaları gerekir.
Oktet kuralı, bir atomun son katmanını değerlik elektron aracılığıyla doldurması olayına verilen isimdir. Örneğin bir katman maksimum 8 elektron taşıyabiliyorsa ve o katmanda 8 adet elektron varsa o atom oktet kuralına uymuş olur. Atomlar bu işlem sürecinde kısa yolu tercih ederler. 8 elektron taşıma kapasitesine sahip bir katmanda 6 adet elektron varsa atom, 6 elektronu vermek yerine 2 elektronu almayı tercih eder.
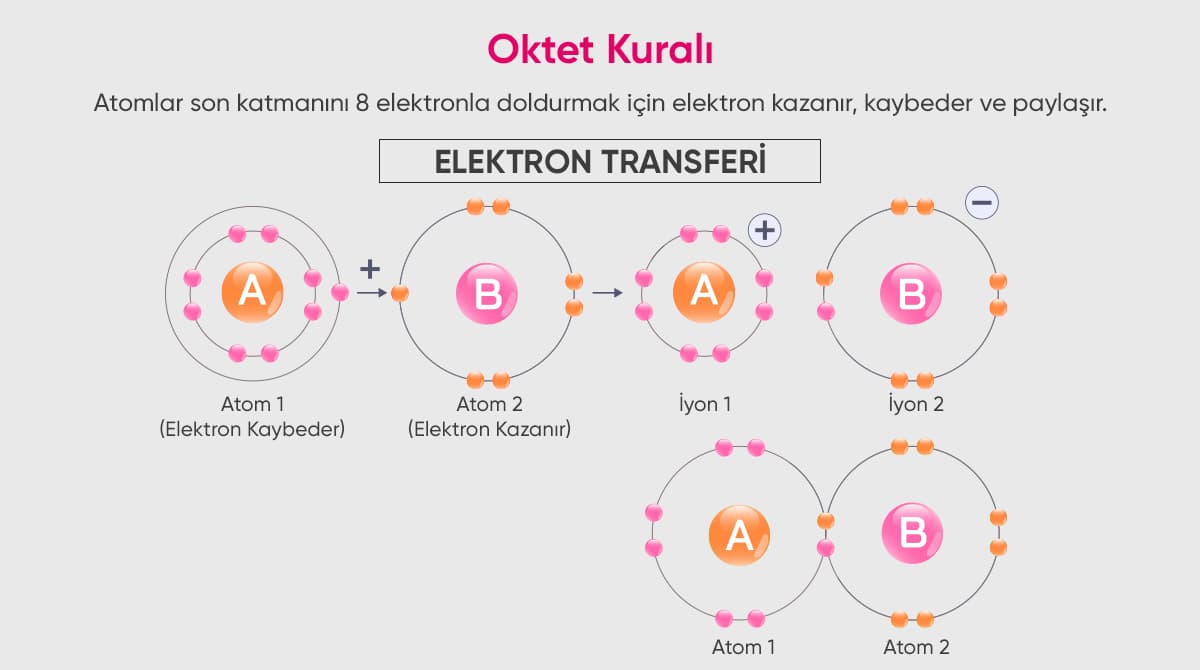
Aynı şekilde son katmanında 2 elektron bulunan bir atom 6 adet elektron almak yerine mevcut 2 elektronunu vermeyi seçer. 2 elektron vererek fazla yükten kurtulan atom +2 yüklenerek kararlı hale gelir ve bu olaya iyonlaşma denir.
Atomların tüm bu işlemleri gerçekleştirebilmesi için ihtiyaç duyduğu iyonlaşma enerjisi en az alkali metallerde bulunur. Metalik özellik arttıkça elektron koparmak aynı ölçüde kolaylaşır. Bu sebeple metalik özelliği yoğun olan alkali metallerde iyonlaşma enerjisi düşüktür.
Periyodik sistemdeki atomların konumuna ve kimyasal yapılarına göre değişkenlik gösteren iyonlaşma enerjisi özellikleri, kimyanın önemli araştırma konularından bir tanesidir. Kimyasal tepkimeleri daha iyi anlamak ve sistematik hareketlerini gözlemlemek, iyonlaşma enerjisi başta olmak üzere çeşitli kimyasal formülleri bilmekle mümkündür.
Siz de kimya biliminin en önemli kavramları içerisinde yer alan iyonlaşma enerjisi hakkındaki bu yazıyı yorumlayabilir, daha çok kişiye ulaşması için çevrenizdekilerle paylaşabilirsiniz.

 Online İşlemler
Online İşlemler Başvuru Sorgula
Başvuru Sorgula Güvence Bedeli Öde
Güvence Bedeli Öde Tesisat Numarası Sorgula
Tesisat Numarası Sorgula Tazminat Bedeli Sorgula
Tazminat Bedeli Sorgula Otomatik Ödeme Talimatı Sorgula
Otomatik Ödeme Talimatı Sorgula İş Ortaklığı Başvurusu Yap
İş Ortaklığı Başvurusu Yap





Yorum Yap